FDA din Arabia Saudită aprobă înregistrarea „Anktiva" pentru tratamentul revolutionar anti-cancer VIDEO
Postat la: 20.01.2026 14:32 | Scris de: ZIUA NEWS
Autoritatea Saudită pentru Alimente și Medicamente (SFDA) a acordat aprobarea condiționată pentru Anktiva (nogapendekin alfa inbakicept) în combinație cu imunoterapia pentru pacienții adulți cu cancer pulmonar non-microcelular metastatic (NSCLC) a căror boală a progresat după tratamentul standard.
SFDA este prima autoritate de reglementare la nivel mondial care acordă aprobarea condiționată pentru acest medicament pentru tratamentul NSCLC. În plus, SFDA a aprobat utilizarea Anktiva în combinație cu Bacillus Calmette-Guérin (BCG) pentru pacienții adulți cu cancer de vezică urinară non-invaziv muscular (NMIBC) cu carcinom in situ (CIS) cu risc ridicat, care nu răspund la BCG.
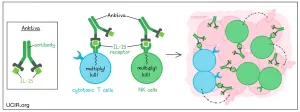
Anktiva are un mecanism inovator prin legarea de receptorul IL-15, ceea ce duce la proliferarea și activarea celulelor natural killer (NK), CD4+, CD8+ și a celulelor T de memorie, fără proliferarea celulelor Treg imunosupresive. Pentru pacienții cu NSCLC, Anktiva se administrează prin injecție subcutanată; pentru pacienții cu NMIBC, se administrează prin instilare intravezicală direct în vezică.
Aprobarea Anktiva se bazează pe o evaluare cuprinzătoare a tuturor dovezilor disponibile, inclusiv eficacitatea, siguranța și calitatea, în conformitate cu cerințele de reglementare. Pentru NSCLC, rezultatele unui studiu clinic cu un singur braț la pacienții care nu au răspuns anterior la una sau mai multe terapii, inclusiv inhibitori ai punctelor de control imunitar, au demonstrat o potențială îmbunătățire a supraviețuirii. Pe baza acestor constatări, SFDA a acordat aprobarea condiționată pentru această indicație. Pentru a menține acest statut de aprobare, este necesar un studiu de confirmare care să demonstreze beneficiile clinice pe termen lung.
Pentru NMIBC, rezultatele studiului clinic au arătat o rată de răspuns complet de 62%. Aprobarea pentru această indicație s-a bazat pe rata de răspuns complet ca obiectiv principal. În ansamblu, aceste rezultate au determinat SFDA să considere Anktiva ca o nouă opțiune de tratament pentru pacienții cu alternative terapeutice limitate, contribuind la îmbunătățirea rezultatelor bolii și a supraviețuirii.
SFDA a raportat că cele mai frecvente evenimente adverse în studiile clinice privind cancerul de vezică urinară au inclus creșterea creatininei, urinarea dureroasă sau dificilă, sânge în urină și urgență sau frecvență urinară. Alte efecte secundare raportate au inclus infecții ale tractului urinar, creșterea potasiului, dureri musculare și osoase, frisoane și febră.
În studiile clinice privind cancerul pulmonar, cele mai frecvente evenimente adverse au inclus reacții la locul injectării, cum ar fi roșeață, durere sau mâncărime, precum și frisoane, oboseală, febră, greață, simptome asemănătoare gripei și pierderea poftei de mâncare.
Această aprobare reflectă angajamentul continuu al SFDA față de inovare și extinderea accesului la opțiuni de tratament avansate, îmbunătățind astfel calitatea asistenței medicale în conformitate cu obiectivele Programului de transformare a sectorului sănătății, una dintre inițiativele cheie ale Viziunii Saudite 2030.